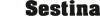Adalimumab, trastuzumab, rituximab, bevacizumab, cetuximab, infliximab. La più grande sfida del farmaco e della sanità europea è in questi sei, impronunciabili nomi. Sei password per accedere al livello superiore: quello delle cure innovative e salvavita a prezzi accessibili, a prova di tagli alla spesa sanitaria. Succederà di qui al 2019, quando scadranno i brevetti dei sei medicinali biologici etichettati con i complicatissimi nomi di cui sopra. Molecole di ultima generazione – sono tutti anticorpi monoclonali – e molto diffuse, che presto vivranno la stessa svolta già toccata a tanti farmaci tradizionali: perderanno il marchio esclusivo e potranno essere riproposti come equivalenti.
Biosimilari, non equivalenti
Per la precisione, nel caso dei biologici a brevetto scaduto, si deve parlare di medicinali biosimilari. La dicitura “generico” o “equivalente” vale – in senso stretto – solo per il farmaco di concezione tradizionale, stabile e ottenuto per sintesi chimica. I farmaci biologici sono di tutt’altra pasta: sono molecole prodotte da organismi viventi, combinazioni di cellule vive e ottenute con un processo di produzione biotecnologica molto più delicato. Ecco perché i biosimilari possono essere simili ma non identici. E, prima di poterli mettere in commercio, si deve dimostrare che abbiano analoga efficacia rispetto al farmaco originatore.
Una questione di soldi e di etica
Che l’avvento dei biosimilari sia un fatto importante e anche una buona notizia è facile capirlo. A prescindere dal tipo di farmaco, ad ogni brevetto scaduto è un muro che crolla. Finisce l’era dei diritti esclusivi, inizia quella della concorrenza, il prezzo del medicinale arriva a calare anche del 75 per cento. S’innesca insomma un risparmio immediato sia per i cittadini sia a livello di spesa sanitaria. “Equivalenti e biosimilari hanno prodotto risparmi per oltre 4 miliardi di euro dal 2000 ad oggi”, ha spiegato a giugno – a margine del convegno nazionale – il presidente di Assogenerici Enrique Häusermann. Che aggiunge: “L’economia sanitaria non è una fredda questione di numeri, ma una forma di etica. Quando le risorse sono limitate, si rischia di lasciare senza cure qualcuno. Di solito i più deboli”.
Cure importanti verso la liberalizzazione
Quelle permesse dai farmaci biologici sono cure innovative, mirate, di alta qualità. Riguardano spesso malattie invalidanti o croniche, con cui i pazienti devono convivere per molto tempo. Così la rivoluzione dei biosimilari, la progressiva liberalizzazione che riguarda questa classe di medicinali, è in qualche modo più importante e decisiva di quella portata a suo tempo dai generici. Anche per un altro motivo: i biologici sono i farmaci con il tasso di crescita più alto di anno in anno. Torniamo alle sei molecole scioglilingua da cui siamo partiti e prendiamo l’adalimumab: un medicinale usato per il trattamento dell’artrite reumatoide e del morbo di Crohn. Ebbene, la sua versione commerciale – Humira – è il farmaco “best seller” del 2014, nei 28 Stati della Ue. Al quarto posto della classifica c’è invece trastuzumab, che – venduto come Herceptin – è un costosissimo e diffuso farmaco antitumorale, usato in modo specifico per il cancro alla mammella.
 Un “tesoretto” di 500 milioni, nel 2018
Un “tesoretto” di 500 milioni, nel 2018
I brevetti per questi due farmaci, ma anche quelli che riguardano le altre quattro molecole che abbiamo citato all’inizio, scadranno di qui al 2019. Nel caso di trastuzumab già nell’anno in corso. I benefici saranno enormi e tutti a carico del sistema sanitario nazionale, come spiega ancora Enrique Häusermann: “La spesa farmaceutica sul territorio è scesa e continua a scendere grazie ai generici. Quella ospedaliera invece non sta calando, perché i farmaci innovativi ad alto costo hanno un impatto soprattutto sugli ospedali. Ebbene, questi sei importanti farmaci con il brevetto in scadenza nei prossimi anni rappresentano una spesa globale di 57 miliardi di euro, un miliardo e mezzo dei quali solo in Italia. Stimiamo risparmi che potranno arrivare a 500 milioni di euro nel 2018”.
La sicurezza e il nodo dell’approvazione
Va da sé che la scadenza di un brevetto non porta automaticamente alcun risparmio. Perché questo si materializzi, c’è bisogno che i biosimilari siano pronti a entrare in commercio. Svilupparne uno può richiedere anche più di dieci anni di ricerca, prove di laboratorio, test clinici e le case produttrici si muovono con congruo anticipo rispetto all’esaurirsi dei brevetti. Ma c’è un altro nodo: l’approvazione del farmaco. Nella Ue ad occuparsene è l’EMA, agenzia europea per i medicinali. Ed è un passaggio non banale, proprio perché i farmaci biologici sono più sofisticati di quelli tradizionali e la questione della loro sicurezza è – se possibile – ancora più delicata.
Politiche e pratiche
Anche la politica e le istituzioni hanno un ruolo decisivo, quando si parla di farmaci equivalenti e biosimilari. Prima di tutto c’è l’opera per rimuovere gli ostacoli alla concorrenza e favorire l’adozione dei generici a livello pubblico e privato, con un esempio su tutti: il decreto Balduzzi del 2012, che ha imposto ai medici di base di compilare le ricette con il nome del principio attivo e non quello commerciale del farmaco. Ma la politica ha molto da dire anche a valle di tutto il processo, quando si parla di risorse. “C’è un concetto per noi importantissimo: i risparmi prodotti in sanità devono rimanere all’interno dell’assistenza farmaceutica”, dice ancora Häusermann. “Vogliamo usare i risparmi ottenuti dai biosimilari per fare in modo che il nostro sistema sanitario diventi davvero universalistico, e non solo sulla carta? Vogliamo usarli perché i diritti dei cittadini e dei pazienti non siano sanciti nella teoria e sistematicamente negati nella realtà? Questa è la sfida, la vera sfida alla quale tutti siamo chiamati a rispondere, ognuno per la sua parte”.